MEDISAN 2026;30:e5405
Relación del microbioma de la leche materna humana con enfermedades autoinmunes y neurodegenerativas
Relationship of the microbioma in human breast milk with autoimmune and neurodegenerative diseases
1Facultad de Medicina No 1. Santiago de Cuba, Cuba.
2Universidad de Oriente. Centro de Estudios Pedagógicos Manuel F. Gran. Santiago de Cuba, Cuba.
Autor para la correspondencia: Correo electrónico: nancy.rodriguez@infomed.sld.cu
Recibido: 09/09/2025
Aprobado: 05/01/2026
RESUMEN
Tradicionalmente, se pensaba que la leche materna humana (LMH) estaba desprovista de microorganismos, hoy se conoce como único alimento para los lactantes, contiene significativa cantidad de organismos vivos y un sin número de bacterias, virus, arqueas, eucariotas como hongos incluso protozoos que tienen funciones fisiológicas, metabólicas e inmunológicas que componen la microbiota de la leche humana y ejercen un efecto protector. El objetivo de esta investigación es describir aspectos importantes sobre la microbiota de la leche materna humana, su interrelación con la aparición de las principales enfermedades autoinmunes y neurodegenerativas con métodos teóricos como sistematización, análisis-síntesis, sistémico-estructural, funcional, en la búsqueda de conocimientos científicos, mediante el estudio y revisión de la literatura científica y su análisis teórico-metodológico. Se concluye que la microbiota de la leche materna humana tiene características únicas, además de una función en el eje cerebro-intestino-microbiota, establece comunicación con los sistemas nervioso central, nervioso entérico, endocrino e inmune con los microorganismos de nuestro intestinoLa ruptura de su equilibrio conlleva al desarrollo de enfermedades autoinmunes y neurodegenerativas.
ABSTRACT
Traditionally, human breast milk (HBM) was thought to be devoid of microorganisms. Today, it is known as a unique food for infants, containing a significant number of living organisms and countless bacteria, viruses, archaea, eukaryotes such as fungi, and even protozoa that have physiological, metabolic, and immunological functions. These organisms comprise the microbiota of human milk and exert a protective effect. The objective of this work is to describe important aspects of the microbiota of human breast milk and its interrelation with the development of major autoimmune and neurodegenerative diseases. This work employs theoretical methods such as systematization, analysis-synthesis, systemic-structural, and functional approaches in the pursuit of scientific knowledge. Through the study and review of scientific literature and its theoretical-methodological analysis, it is concluded that the microbiota of human breast milk has unique characteristics. Furthermore, it plays a role in the brain-gut-microbiota axis and establishes communication with the central nervous, enteric nervous, endocrine, and immune systems. The disruption of the balance of the intestine leads to the development of autoimmune and neurodegenerative diseases.
INTRODUCCIÓN
La leche materna humana (LMH) es considerada durante décadas como un fluido estéril, limitado a funciones nutricionales básicas. Actualmente se conoce que la LMH es una fuente rica en microorganismos que conforman el microbioma de la leche humana natural, desempeña funciones esenciales en la salud del lactante e interactúa con su sistema inmunitario y con el metabolismo.1
Cabe destacar que la LMH es considerada "el alimento probiótico prototipo de la madre naturaleza", secreción fisiológica muy completa, óptima para la alimentación posnatal del recién nacido desde la existencia de la humanidad, contiene nutrientes esenciales, células inmune, mediadores inmune como Inmunoglobulina As y M, hormonas, factores de crecimiento, de defensa innatos, también moléculas no nutritivas glicoproteínas, polisacáridos y una gama de microorganismos que cooperan en la salud actual y posterior del niño, conocida como microbioma de la leche humana (MLH).2
Este microbioma incluye bacterias beneficiosas como Lactobacillus y Bifidobacterium, fundamentales para la colonización del intestino neonatal y la maduración del sistema inmunológico, algunos autores preconizan que los niños que ingieren un promedio de 800 ml de leche materna diario introducen a su intestino 105 a 107 bacterias comensales,3 aun así, a finales de los 60, la existencia de microorganismos en la leche humana (LH) era considerada consecuencia de los bajos niveles de higiene personal y ambiental.1,2
Avances tecnológicos como la metagenómica, biología sintética y la secuenciación de nueva generación han permitido caracterizar esta microbiota, al identificar su influencia en la aparición de enfermedades inmunológicas, inflamatorias y degenerativas del sistema nervioso, a pesar de estos avances, persisten desafíos como la variabilidad en los métodos de análisis, las diferencias geográficas y culturales en las muestras estudiadas y la falta de investigaciones longitudinales que tipifiquen los efectos a largo plazo de la disbiosis en la LMH.4
Según la Organización Mundial de la Salud (OMS), la lactancia materna exclusiva durante los primeros seis meses del nacimiento puede reducir significativamente la morbimortalidad infantil, su impacto en el desarrollo del eje cerebro-intestino-microbiota y su relación con trastornos autoinmunes y neurodegenerativos sigue siendo un área de investigación emergente, además la creciente integración de disciplinas como la psico-neuro-endocrino-inmunología permite explorar cómo factores emocionales, endocrinos y microbianos interactúan para influir en la salud materno-infantil.5,6
Las bacterias de la microbiota intestinal están relacionadas con las funciones intestinales sobre todo a nivel de las barreras mucosas, así como en el metabolismo de los nutrientes y contribuye al establecimiento del eje neural intestino-cerebro para desempeñar una función fundamental en el desarrollo del sistema inmunitario innato y adaptativo.7
A pesar de los avances en estudios de la microbiota de la leche materna, la literatura actual carece de enfoques que relacionen estos hallazgos con la formación de profesionales en inmunología, lo que limita su aplicación práctica en contextos clínicos. Por ello, este estudio incorpora un enfoque innovador basado en la psico-neuro-endocrino-inmunología, permite explorar como influye el microbioma, el sistema inmune y factores neuroendocrinos en la salud. En este contexto resulta crucial que los futuros especialistas en inmunología comprendan la función de la microbiota de la (LMH), sus alteraciones (disbiosis), la aparición y mejor tratamiento de enfermedades, no solo los capacita para asesorar a las futuras madres, sino también para abordar problemas de salud con enfoque integral hacia una actuación profesional informada. Por lo antes expuesto se realiza el presente artículo con el objetivo de describir aspectos relevantes sobre la microbiota de la leche materna humana, su función en la aparición de las principales enfermedades autoinmunes y neurodegenerativas, para el mejor desempeño de los residentes de Inmunología desde la óptica de la psico-neuro-endocrino-inmunología.
MÉTODOS
Se realizó una amplia revisión de la literatura científica nacional e internacional, a partir de bases de datos de Internet, Lilacs, Scielo, PuMed, Medline y el motor de búsqueda Google Scholar. se emplearon como descriptores "microbioma de la leche materna; microbiota intestinal infantil; lactancia materna; eje cerebro-Intestino-microbioma; disbiosis neonatal", y se seleccionaron los que cumplieron los siguientes criterios.
- Haber sido publicados entre el 2020 y el 2025
- Integrar contenidos de lactancia materna, eje cerebro-intestino-microbioma, relacionados con la aparición de enfermedades autoinmunes y neurodegenerativas con enfoque desde la psico-neuro-endocrino-inmunología, considerado como filtro de resultado
- Ser publicado en idioma español o inglés
Así se revisaron 65 artículos que cumplían los requisitos de octubre, 2024 a febrero, 2025, se excluyeron 22 que repetían la misma información referente al filtro de resultado, para un total de 43.
Para la fundamentación del trabajo se emplearon métodos como:
- Sistematización para la integración e interrelación de los elementos de la microbiota de la LMH analizado por otros autores, esclareciendo características comunes y generales con distintos enfoques.
- Análisis-síntesis para el resumen, valoración e interpretación de los datos recogidos y la obtención de conclusiones epistemológicas sobre la (LMH).
- Inductivo-deductivo: para la toma de posiciones teóricas del tema que permitieron arribar a conclusiones.
DESARROLLO
El microbioma humano normal, apareció por primera vez en la literatura científica como flora microbiana normal actualmente se ha bautizado como microbioma, considerado un segundo genoma o un nuevo órgano descubierto a finales de los años 90 del siglo pasado.8
La relación entre el huésped y el conjunto de microorganismos de un sitio anatómico, donde confluye una compleja interacción de factores genéticos, condiciones ambientales circundantes y metabólicas, que pueden inducir la expresión o manifestación de una respuesta fisiológica o patológica en el individuo.9
1. Microorganismos que componen la microbiota de la leche materna humana.
Antiguamente se especulaba que la leche materna era un líquido incoloro carente de microorganismos por lo que no requería de estudios microbiológicos. A partir del 2003 comenzaron a salir resultados de análisis de laboratorios de microbiología que apuntaban hacia la posibilidad de la existencia de organismos vivos en la leche de puérperas con buen estado de salud, hoy se ha verificado la presencia de diferentes gérmenes entre los que podemos citar bacterias, viruses, hongos, protozoos, arqueas entre otros (tabla1), se ha identificado su presencia en el intestino de la madre por lo que se pudiera inferir que llegan a la glándula mamaria por alguna vía y así sea transferido al bebé.10
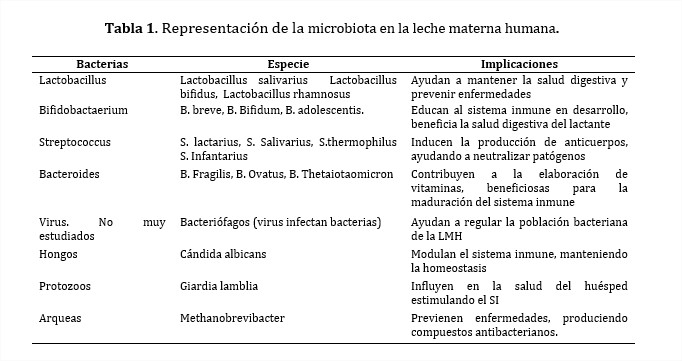
En los lactantes alimentados con el seno materno abundan los Lactobacillus bifidus y Bifidobacterium spp. que conforman el 95 % de los organismos cultivables y otros microorganismos poco frecuentes, en relación con los lactantes alimentados con fórmulas lácteas que tienen la flora intestinal conformada por bacterias gramnegativas, fundamentalmente organismos coliformes y Bacteroides.
Sin embargo, estudios recientes afirman la alteración de la microbiota por factores maternos (obesidad, dieta, estado inmunitario, edad), factores postnatales (uso de antibióticos, tipo de parto), factores ambientales (la contaminación, tabaquismo, productos químicos), la genética tanto del bebé como de la madre, la epigenética, además los trastornos de la microbiota en el neonato a término o el prematuro se asocia con enfermedades inflamatorias intestinales, respiratorias y con mayor riesgo de infecciones intrahospitalarias.10
También se plantea que el consumo de leche humana reduce significativamente el número y la gravedad de las infecciones infantiles a corto y largo plazo, evita algunos procesos alérgicos, aseveración compartida por los autores, que reconocen que sería de interés la adquisición de este conocimiento en la formación del futuro inmunólogo.
2. Origen de la microbiota de la leche materna humana.
El origen de las comunidades bacterianas benéficas en la LMH es discutible y tiene características diferentes a la de otros ecosistemas del organismo, al respecto se postulan dos vías para justificar la llegada y/o presencia de bacterias en la leche materna humana.
La primera vía y más aceptada en la literatura internacional, plantea que la microbiota encontrada en la leche materna era debido a contaminación por bacterias comensales de la piel alrededor de la glándula mamaria, la flora de la cavidad oral y gastrointestinal del neonato asumiendo un paso de bacterias desde la boca del niño a la glándula mamaria y por consiguiente a la leche materna, mediante el contacto directo entre la piel del lactante y la mama de la madre, favorecida por un flujo retrógrado entre los conductos mamarios y obtenidas desde el intestino materno o a través de la saliva del lactante que entra en contacto con la mama durante la succión, además de su inoculación a través del paso por el canal del parto Esta transferencia se conoce como "trasplante natural de bacterias"
Otra vía, conocida como "Migración Activa" para ser la segunda, se apoya en una ruta entero-mamaria-endógena, que de alguna forma indica que algunas bacterias de la microbiota gastrointestinal materna se establecen en la glándula mamaria, que se facilita por un incremento en la permeabilidad del intestino materno, seguido por el efecto hormonal sobre las uniones estrechas de los enterocitos, en las últimas etapas del embarazo y en las primeras de la lactancia.
Estos antígenos de (virus, bacterias y hongos intestinales) ingeridos por la madre se adhieren al epitelio intestinal y son capturados por las células M, los transporta a las placas de peyer sitio en que son presentados por los macrófagos a los linfocitos T, a su vez estimulan a los Linfocitos B, que proliferan y migran por el conducto torácico hasta las mamas, convirtiéndose en células plasmáticas productoras en este caso de Inmunoglobulinas A, que son secretoras monoméricas y forman dímeros que se unen al componente secretor, producidas en la leche materna donde finalmente pasan al neonato confiriéndole múltiples beneficios.11
Coincidimos con varios autores en que estas alteraciones bacterianas a nivel intestinal principalmente la pérdida de ácidos grasos de cadena corta, junto al aumento de la permeabilidad intestinal contribuyen a desarrollar una respuesta inflamatoria entérica, desregulación del motor intestinal, con inflamación periférica crónica que constituyen los pilares para la aparición y desarrollo de enfermedades autoinmunes y neurodegenerativas.
3. Factores para el establecimiento de la microbiota de la leche materna humana.
Los factores que posibilitan el establecimiento de la microbiota de la leche materna, pueden ser:
- Factores internos maternos: (edad, genética, alimentación, estado de salud, microbiota cutánea e intestinal)
- Factores internos del bebé (sexo, peso al nacer, microbiota oral y gastrointestinal)
- Factores externos: (tipo de parto, uso de antibióticos, exposición ambiental, hábitos alimentarios, otros hermanos)
- Factores del amamantamiento:( tiempo de lactancia materna exclusiva, técnica utilizada, fase de la misma y sus componentes).
Luego del nacimiento, el factor más influyente en el establecimiento y desarrollo de la microbiota intestinal del neonato es la leche materna,7,11 que ha sido establecida mediante el eje entero-mamario, aspecto de interés a incorporar en los programas de estudios del residente de inmunología para el desempeño proactivo y holístico del futuro inmunólogo en su actuación profesional frente a las futuras madres.
4. Fisiología de la microbiota de la leche materna.
El establecimiento en el intestino del lactante de las bacterias de la leche materna previene enfermedades en la que medie el sistema inmune en la infancia y en el óptimo estado de salud futura del niño, puesto que esto contribuye al desarrollo del eje neural intestino-cerebro desempeñando un papel importante en la maduración y desarrollo del sistema inmunitario innato y adaptativo.12
Las bacterias en el intestino colaboran con la conformación de la barrera epitelial intestinal, estimulan las células linfoides e influyen en la aparición de microvellosidades y las interacciones entre células epiteliales, que estimula la producción de mucina por las células caliciformes con la consiguiente formación de la glicocálix como barrera física y antibacteriana. Evidencias científicas actuales señalan que los receptores de los enterocitos y las células inmunitarias de la mucosa interactúan con ligandos expresados o secretados en las superficies microbianas para desencadenar una respuesta inflamatoria innata autolimitada frente a la penetración de patógenos en la mucosa.
En relación con la inmunidad adaptativa, las bacterias que yacen en el lumen interaccionan mediante receptores de reconocimiento de patrones y estimulan la liberación de interleucinas por células dendríticas, que posibilitan un microambiente que permite a los linfocitos T helper (Th) naive madurar y convertirse en células Th1/Th2 de equilibrio.7 Así se manifiesta la ley fundamental de la Inmunología, es decir, la dinámica de la respuesta inmune a nivel del lumen intestinal, al tener en cuenta que aquí se debe discriminar entre los grandes volúmenes de alimentos diarios y la gran cantidad de comensales y patógenos. Como consecuencia, se desencadenan respuestas inflamatorias agudas firmes, frente a comensales y alimentos que desarrollan respuestas antinflamatorias permanentes, y permiten la vida del ser humano, conocimiento de vital importancia en la formación del residente de Inmunología en cuanto a sistema mucoso se refiere.
5. Rol de la microbiota de la leche materna humana en la aparición de enfermedades autoinmunes y neurodegenerativas.
Los microorganismos que conforman la microbiota de la glándula mamaria son bacterias benéficas que acceden a las mamas mediante las vías explicadas anteriormente. Al comenzar la lactancia, llegan al intestino de los bebés alimentados desde el seno materno, sin embargo, la modulación neuro-endocrino-inmune; con funciones protectora, estructural, metabólica y moduladora del sistema inmune es la que conforma la microbiota intestinal del neonato.
Hace varios años se habla en la literatura científica de una comunicación bidireccional entre el sistema nervioso entérico y el sistema nervioso central, conocido como eje microbiota-intestino-cerebro. Algunos autores referencian que el cerebro influye en la microbiota intestinal a través de la secreción de neuropéptidos, hormonas, neurotransmisores y ácidos grasos de cadena corta (AGCC) asimismo la microbiota intestinal modula la función cerebral y el comportamiento.
Estudios recientes dan cuenta que los lactobacilos de la leche materna son indispensables para llevar a cabo la óptima función de este eje, por lo tanto la función de la microbiota intestinal es importante en numerosas funciones vitales contribuyendo de forma directa con la salud del cuerpo.13,14
Surge un nuevo paradigma en la salud, la psico-neuro-endocrino-inmunología que es la nueva concepción en fisiología y fisiopatología clínica como fenómeno dialéctico y supra-sistema integrador con una visión integral de la salud que asume la posición de que las emociones, el estrés, la ansiedad ocasionan cambios en el sistema hormonal e inmunitario, los que a su vez interactúan con las bacterias de nuestro intestino, lo que permite afirmar que estos tres sistemas y su estado de salud están regulados convenientemente por el estado de eubiosis, de ahí que, el origen de muchos trastornos se encuentren a nivel de este gran órgano metabólico por lo que, cuanto más variadas sean las bacterias del ecosistema intestinal, mayor es la inmunidad frente a la enfermedad.15
Las relaciones entre las emociones y el sistema inmune tendrán lugar cuando el sistema inmune, por la causa que fuera, secreta sustancias inflamatorias que disminuyen los niveles de serotonina y dopamina, neurotransmisores que regulan los estados de ánimo y las emociones al transportar mensajes desde las neuronas que las producen hasta las diferentes células, la dopamina es secretada en las neuronas dopaminérgicas situadas en el tronco encefálico y el hipotálamo, asociada con acciones del cerebro como la articulación de movimientos, la memoria, toma de decisiones, la motivación, el aprendizaje y la recompensa, mecanismos del cerebro que nos obliga a repetir una conducta. Fuera del cerebro tiene acciones sobre el peristaltismo intestinal, la actividad hormonal, la presión sanguínea, así como en la función de las células inmunes.
En ese mismo orden la serotonina, neurotransmisor que regula el estado de ánimo, el sueño, el apetito y las funciones cognitivas, relacionada con el equilibrio emocional, el bienestar, la felicidad, en procesos del aprendizaje y la memoria junto a la dopamina se fabrican en un 80 % en el intestino, pero cuando hay ruptura en el equilibrio de los microorganismos que componen la microbiota intestinal se produce inflamación a ese nivel con la consiguiente disminución de la secreción de estos neurotransmisores, lo cual afecta al cerebro.16
En la figura 1 se representan los niveles bajos de dopamina que se manifiestan con síntomas como fatiga, falta de motivación, depresión, falta de apetito, dificultades para la concentración que puede llegar a los temblores, trastornos que afectan el movimiento. Mientras que niveles bajos de serotonina se manifiestan por ansiedad, cambios repentinos del carácter, marcada depresión, dificultades para conciliar y mantener el sueño, trastornos gastrointestinales, y el estado de ánimo.17
La disbiosis, entendida como la alteración de la diversidad, composición y metabolitos secretados por la microbiota intestinal y la respuesta no controlada del hospedero a estos cambios, se asocian por lo general a un crecimiento exponencial de microrganismos patógenos con disminución importante de la variedad microbiana y grupos de bacterias benéficas.
Estos cambios traen consigo desregulación inmunitaria y esta a su vez susceptibilidad a infecciones y una respuesta inflamatoria del individuo que puede convertirse en crónica y contribuir al desarrollo de enfermedades inmunitarias e inflamatorias como alergia, asma, enfermedad inflamatoria del intestino, enterocolitis necrosante en prematuros, enfermedad celíaca, diabetes mellitus tipo 1, obesidad y también trastornos neurológicos y cognitivos, entre otras patologías.18
La disbiosis intestinal son consecuencias de variados factores ambientales como lo son la dieta pobre en fibras, algunas toxinas, drogas con uso desmedido y microorganismos patógenos. Estos agentes microbianos son capaces de mediar en la inflamación a nivel sistémico alterando la composición de la microbiota, su función de barrera protectora y de mecanismo de control para evitar la aparición de enfermedades inmunomediadas y extra-intestinales particularmente aquellas que involucran el eje microbiota-intestino-cerebro, y afecta de esta forma el sistema nervioso central (SNC) y las funciones cognitivas.19,20
Actualmente aparecen cada vez más datos que relacionan factores psicológico, inmune, endocrino con la microbiota intestinal, con este enfoque la psico-neuro-endocrino-inmunología da respuesta a la relación entre los mecanismos regulatorios y de control de la homeostasis del organismo y abarca la salud de forma integral centrada en la interconexión entre la mente, (SNC), sistema endocrino (SE); sistema inmune (SI) y su relación con la microbiota intestinal.
Teniendo en cuenta esta comunicación bidireccional, así como la interdisciplinaridad de los factores que participan en estos procesos, se explica la fisiopatología del por qué aparecen en los pacientes con enfermedades autoinmunes y neurodegenerativas trastornos gastrointestinales, psicológicos y psiquiátricos, lo cuál debe ser del conocimiento por parte de los residentes de Inmunología.21,22
Cada vez más las evidencias sugieren que cambios anormales en los microorganismos que componen la microbiota intestinal (disbiosis), alteraciones en la barrera que forma el epitelio intestinal, respuesta inmune descontrolada ante estímulos patogénicos y cambios adaptativos en el sistema nervioso entérico representan los principales factores implicados en la patogénesis de varios trastornos intestinales y otros trastornos gastrointestinales funcionales.
Desde este punto de vista, la microbiota intestinal es considerada actualmente clave fundamental en las interacciones con los demás componentes de regular tanto el mantenimiento como la ruptura de la homeostasis intestinal. Las bacterias entéricas interactúan directamente con el epitelio intestinal el cual, junto con la capa de moco representan la barrera interpuesta entre el contenido luminal y los compartimentos inmunes, neuronales y musculares subyacentes.
El epitelio del intestino lo conforman un subconjunto de células epiteliales, las cuales están estrechamente unidas por complejos de unión intercelular (proteínas de unión estrecha, tales como ocludinas, zonulina-1 y claudinas, uniones adherentes y desmosomas) que aseguran la funcionalidad del epitelio como barrera para regular la permeabilidad celular.
Cambios específicos en la composición de la microbiota intestinal pueden conducir al quebrantamiento de la barrera epitelial intestinal con incremento de la permeabilidad de la mucosa, lo que trae como consecuencia la translocación bacteriana en la mucosa y su posible diseminación sistémica, además, el epitelio intestinal y la microbiota intestinal interactúan directamente con el sistema inmune entérico contribuyendo al mantenimiento de la tolerancia inmune y conformación de la respuesta inmune durante la inflamación mediante la interacción de patrones moleculares asociados a microbios (MAMPs), presentes en la microbiota intestinal que activa receptores de reconocimiento de patrones tipo toll, presentes en la superficie de células innatas, contrariamente a lo que ocurre a la llegada de patógenos invasores (disbiosis) o ruptura de la barrera, MAMPs estimulan macrófagos o células dendríticas para producir citosinas-proinflamatorias que a su vez activan células inmune adaptativas lo que contribuye así a la ruptura de la homeostasis inmune.
Existen estudios que sugieren que la microflora intestinal influye en el desarrollo y función del (SNE) por tanto las bacterias entéricas son determinantes importantes en el tropismo del sistema nervioso entérico.
El sistema nervioso entérico está compuesto por dos plexos, el plexo mientérico o de (Auerbach's) y el plexo submucoso o de (Meissner's), red semiautónoma neural intrínseca que regula funciones digestivas (ej. motilidad y secreción) y coopera con el sistema nervioso central (SNC) mediante la vía simpática y parasimpática. Un importante componente del SNE, lo constituyen las células gliales entéricas (EGCs) asociadas con ambas neuronas myentéricas y de la submucosa. Estas células están involucradas en el mantenimiento de la integridad del SNE así como de la barrera epitelial.
Hasta aquí podemos decir, que la disbiosis intestinal las alteraciones morfofuncionales de la barrera del epitelio intestinal, la activación de células inflamatorias inmunes y cambios neuroplásticos en el sistema nervioso entérico, además de representar los principales factores que subyacen en las enfermedades inflamatorias intestinales se han asociado directamente con la patogénesis de varias enfermedades extradigestivas (obesidad, diabetes Tipo I, enfermedades inmunomediadas y desórdenes neurológicos).23
Por lo tanto, es concebible que las interacciones entre la microbiota intestinal, la barrera epitelial del intestino y el sistema inmune-neuro-entérico, además de preservar la integridad del microambiente intestinal, contribuya también a coordinar varios procesos fisiológicos extradigestivos en el huésped.24
Recientes investigaciones experimentales y clínicas destacan la relevancia de la microbiota intestinal y sus interacciones, la barrera mucosa intestinal, sistema inmune y la vía del nervio vago-sistema nervioso entérico en el mantenimiento de la homeostasis del cerebro.
Se conoce que los cambios en la composición de la microbiota intestinal, principalmente la pérdida de ácidos grasos de cadenas corta producidos por bacterias, junto al incremento de la permeabilidad intestinal conforman una respuesta neurogénica e inflamatoria entérica promoviendo la acumulación de α-syn en las neuronas mientéricas además de la inducción de disfunciones del motor intestinal lo que promueve una condición de inflamación periférica crónica que contribuye a la neurodegeneración y neuroinflamación in el SNC (figura 1).25,26
La experiencia actual basada en evidencias clínicas señala que la microbiota intestinal influye en el desarrollo y la función del sistema inmune por lo que la ruptura de este equilibrio puede dar lugar a desregulación inmunológica contribuyendo de esta forma a la aparición de trastornos autoinmunes crónicos y procesos neurodegenerativos, en ese mismo orden, la microbiota interviene además en la síntesis de neurotransmisores como serotonina y dopamina que influyen en las funciones cerebrales, el comportamiento, el metabolismo y la inmunidad, la desregulación de este sistema serotominérgico está relacionado con la aparición de enfermedades autoinmunitarias y neurodegenerativas.27,28,29
En este contexto se erige el proceso de formación del especialista de Inmunología, que como especialidad transdisciplinaria interviene en todas las funciones médicas para solucionar los problemas de salud relacionados con las afecciones del sistema inmune.30
Por lo antes señalado, se considera la necesidad de que este conocimiento forme parte del proceso de formación de los residentes de Inmunología, para que lleven a cabo un papel protagónico en la orientación a las futuras madres acerca del ¿por qué? es necesario recuperar la milenaria práctica de la alimentación de los niños y niñas al seno materno contribuyendo a la disminución de los índices del programa de atención materno infantil exhibidos por el país, para convertirlos en profesionales competentes en su modo de actuación al garantizar salud presente y futura a la población infantil.

CONSIDERACIONES FINALES
El microbioma de la leche materna humana está compuesto por la red de microorganismos presentes en la glándula mamaria, los cuales llegan hasta aquí procedentes del intestino materno por la ruta entero-mamaria para poblar el intestino neonatal mediante la lactancia materna, conformando la microbiota intestinal del lactante de gran importancia en la salud presente y futura de los bebés.
Las alteraciones en la composición y diversidad de la microbiota intestinal conlleva a la ruptura de las interacciones entre esta, la barrera mucosa intestinal y el sistema neuro-endocrino-inmune-entérico lo que se traduce en pérdida de la homeostasis intestinal, con la consiguiente aparición de síntomas intestinales, desórdenes psicológicos y psiquiatricos conllevando a la aparición de enfermedades autoinmunes y neurodegenerativas desde el enfoque holístico de la psico-neuro-endocrino-inmunología, muchos de esos elementos nos conducen a un diagrama ilustrado en el texto y a explicar el mecanismo de aparición de las principales enfermedades autoinmunes y neurodegenerativas.
REFERENCIAS BIBLIOGRÁFICAS
- Consales A, Cerasani J, Sorrentino G, Momiroli G, Colombo L, Mosca F, et al. El universo oculto del microbioma de la leche humana. Eur J Pediatr. 2022[citado 31/03/2024];181:1811-20 Disponible en : https://link.springer.com/article/10.1007/s00431-022-04383-1
- González-Rodríguez R I, Jiménez-Escobar I, Gutiérrez-Castrellón P. Microbiota de la leche humana y su impacto en la salud humana. Gac. Méd. Méx. 2020[citado 08/12/2025];156(3):58-66. Disponible en: https://www.scielo.org.mx/pdf/gmm/v156s3/0016-3813-gmm-156-Supl3-S58.pdf
- Hernández H. Viggiano, AKR. Microbiota en leche materna, clave para la salud futura. Revista Universitarios Potosinos. 2023[citado 08/12/2025]; 274:(19); 6-6. Disponible en: https://leka.uaslp.mx/index.php/universitarios-potosinos/article/view/501/294
- Zuñiga A, Satuye T, Oreamuno MM, Arias V, Rojas K. Importancia del microbioma en la salud humana y aplicaciones médicas. SIIC. 2023[citado 31/01/2025]. Disponible en: https://www.siicsalud.com/des/expertoimpreso.php/170361
- Unicef. Guía familiar para la lactancia materna y alimentación complementaria. 2020 [citado 11/09/2023];16. Disponible en: https://www.unicef.org/panama/media/2636/file/LACTANCIA%20MATERNA%20GU%C3%8DA%20.pdf
- Barone, M, Ramayo Caldas Y, Estellé, J, Tambosco K, Chadi S, Maillard F. et al. Gut barrier-microbiota imbalances in early life lead to higher sensitivity to inflammation in a murine model of C-section delivery. Microbiome. 2023[citado 25/12/2025]; 11(1): 140. Disponible en : https://link.springer.com/article/10.1186/s40168-023-01584-0
- López Villagrán MA, Maldonado Mariño EV, Silvia Alexandra LS. Importancia de la lactancia materna exclusiva en los primeros seis meses de vida del recién nacido. CCM. 2025[citado 12/12/2025];29(s1):e5288. Disponible en: https://revcocmed.sld.cu/index.php/cocmed/article/view/5288/2674
- TesScience. Monterrey: Instituto Tecnológico y de Estudios Superiores de Monterrey; © 2023[actualizada 2025 Jun 24; citado 23/11/2025]. ¿Qué es el microbioma humano y porqué es importante? [aprox. 3 p.]. Disponible en: https://tecscience.tec.mx/es/salud/microbioma-humano/
- GUT MICROBIOTA FOR HEALTH by ESMN. Vienna: Sociedad Europea de Neurogastroenterología y Motilidad; © 2024[actualizada 2025 Jun 27; citado 23/11/2025]. [aprox. 2 p.] . Disponible en: https://www.gutmicrobiotaforhealth.com/es/dia-mundial-del-microbioma-2024-que-sabemos-y-que-no-sobre-el-potencial-del-microbioma-intestinal-a-la-hora-de-personalizar-el-asesoramiento-nutricional/
- Méndez León EM, Salazar Quiñones IC, Castro Albarrán J. Lactancia materna y microbiota. Rev Med Cientif Sec Salud Jalisco. 2022[citado 12/11/2025];9: 61-5. Disponible en: https://www.medigraphic.com/pdfs/saljalisco/sj-2022/sje221i.pdf
- Sánchez Salguero E. Establecimiento del microbiota intestinal del recién nacido durante la lactancia materna. APM. 2024[citado 18/03/2025];45(3):27-32. Disponible en: https://ojs.actapediatrica.org.mx/index.php/APM/article/view/2792
- Benavidez G, Gerold I, Tabacco O, Vinderola G. Escenarios lácteos y microbiota intestinal en los primeros 1000 días. Arch Argent Pediatr. 2023[citado 21/10/2025];121(6): e202202851. Disponible en: https://www.scielo.org.ar/pdf/aap/v121n6/1668-3501-aap-121-06-11.pdf
- Quishpe BEU, Chunata RNT, Grefa NLA, Unaucho BFE, Carreño A de las MA, Sigcha JCS. Microbioma humano y epigenética: nuevas fronteras en la salud personalizada. S. F. J. of Dev. 2025 [citado 18/03/2025];6(2):e5007. Disponible en: https://ojs.southfloridapublishing.com/ojs/index.php/jdev/article/view/5007
- Mazariegos M, Ramírez Zea M. Lactancia materna y enfermedades crónicas no transmisibles en la vida adulta. ALAN. 2015[citado 08/09/2025];65(3):143-51. Disponible en: https://ve.scielo.org/pdf/alan/v65n3/art02.pdf
- Regenera. ¿Qué es la psiconeuroinmunología y cómo ayuda a la salud? [Blog] .España: Regenera;2020[citado 25/11/2025]. Disponible en : https://regenerahealth.com/blog/psiconeuroinmunologia-que-es/
- Gil Muñoz C. ¿Qué es la dopamina y qué es la serotonina?. [Blog] .España: Gil Muñoz C;2023[citado 25/10/2025]. Disponible en : https://www.salud.mapfre.es/enfermedades/neurologicas/dopamina-y-serotonina/
- Álvarez J, Fernández Real J M, Guarner F, Gueimonde M, Rodríguez JM, Saenz de Pipaon M, et al. Microbiota intestinal y salud. Gastroenterología y Hepatología. 2021[citado 22/12/2024];(44):519-35. Disponible en: https://www.elsevier.es/es-
- Arce Hernández W. Disbiosis intestinal: alteración de la relación mutualista entre microbiota y sistema inmune. Acta Acad. 2020[citado 22/12/2024]; (67):171-82. Disponible en: https://pjenlinea3.poder-judicial.go.cr/biblioteca/uploads/Archivos/Articulo/Wendy%20Arce.pdf
- Jovandaric MZ, Dugalic S, Babic S, Babovic IR, Milicevic S, Mihajlovic D, et al. Programming Factors of Neonatal Intestinal Dysbiosis as a Cause of Disease. Int J Mol Sci. 2023[citado 22/02/2025];24(6):5723. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC10058501/pdf/ijms-24-05723.pdf
- Hanna Jairala I, Drossman D. Neuromoduladores centrales en el síndrome del intestino irritable: porqué, cómo y cuánto. Am J Gastroenterol. 2024[citado 25/09/2025];119(7):1272-84. Disponible en: https://pmc-ncbi-nlm-nih-gov.translate.goog/articles/PMC11208063/?_x_tr_sl=en&_x_tr_tl=es&_x_tr_hl=es&_x_tr_pto=tc1
- Colmenares Castaño M. Lactancia Materna como elemento clave para la integración neurosensorial. Acta Pediatr Mex. 2024[citado 22/10/2025];45(3):3. Disponible en: https://ojs.actapediatrica.org.mx/index.php/APM/article/view/2793
- Infobae. Buenos Aires, Argentina: Infobae, c2023. [citado 22/1/2026]. La leche Materna impulsa un microbioma más saludable en los recién nacidos. Disponible en: https://www.infobae.com/salud/2023/09/17/la-leche-materna-impulsa-un-microbioma-mas-saludable-en-los-recien-nacidos-afirma-un-estudio/
- Mogoş GFR, Manciulea M, Enache RM, Pavelescu LA. Popescu OA, Cretoiu S M, et al. Intestinal Microbiota in Early Life: Latest Findings Regarding the Role of Probiotics as a Treatment Approach for Dysbiosis. Nutrients. 2025[21/12/2025];17(13):2071. Disponible en: https://www.mdpi.com/2072-6643/17/13/2071
- Salvador Ajcuc IC, Ruiz Zamora LS, Caña Ambrocio ZA. Neurociencia y lactancia materna. Revista Académica CUNZAC. 2021[citado 16/10/2025];4(1):53-7. Disponible en: https://revistacunzac.com/index.php/revista/article/view/32/9
- Leonov G, Salikhova D, Starodubova A, Vasilyev A, Makhnach O , Fatkhudinov ,et al. Oral Microbiome Dysbiosis as a Risk Factor for Stroke: A Comprehensive Review Microorganisms. 2024 [citado 16/10/2025];12(8): 1732. Disponible en: https://www.mdpi.com/2076-2607/12/8/1732
- Reyes-Reyes E, Valledor-Estevill RF. Contenidos de inmunología en la formación de médicos residentes en Cuba. Antecedentes, etapas y tendencias. Rev Ciencias Médicas. 2024[citado 08/01/2025];28(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S156131942024000200020&lng=es
- López Villagrán MA, Maldonado Mariño EV, Silvia Alexandra LS. Importancia de la lactancia materna exclusiva en los primeros seis meses de vida del recién nacido. CCM. 2025[citado 19/12/2025];29:e5288. Disponible en: https://revcocmed.sld.cu/index.php/cocmed/article/view/5288
- Alibio Moraes B, Rodrigues Strada JK, Gasparin VA, Cordova do Espirito-Santo L, Geremias Gouveia H, de Carvalho Gonçalves A. Lactancia materna en los primeros seis meses de vida de los bebés atendidos por Consultoría de Lactancia. Rev. Latino-Am. Enfermagem. 2021[citado 19/12/2025];29:e3412. Disponible en: https://www.scielo.br/j/rlae/a/5CS4DJJb7J8j3mPSQHMMFWR/?format=pdf&lang=es
- Rondón-Carrasco J, Morales-Vázquez CL, Rosabal-Pérez K. Papel inmunológico de la lactancia materna en la prevención de enfermedades. Rev Ciencias Médicas. 2024[citado16/01/2025];28(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S156131942024000200022&lng=es
Conflicto de intereses
Los autores expresan no tener conflictos de intereses.
Contribución de los autores
Conceptualización, Metodología: Juan Ramón Castillo Belén: 30 %
Curación de datos, Análisis formal: María Elena Pardo Gómez: 30%
Supervisión: Leonardo Ramos Hernández: 20 %
Validación: Dra. Sheila Tamayo Rivas, Dra. Vivian Molina Hechavarría: 10 %
Visualización: Nancy María Rodríguez Beltrán: 10 %
Revisores: Dra. Virgen Yaneisy Gross Ochoa, MSc. Sara Riccis Salas Palacios
Corregido por: MSc. Delaine Núñez Carbonell